Le tableau ci-dessous représente les nuages électroniques des différents atomes, y compris les principaux atomes constituant les plastiques.
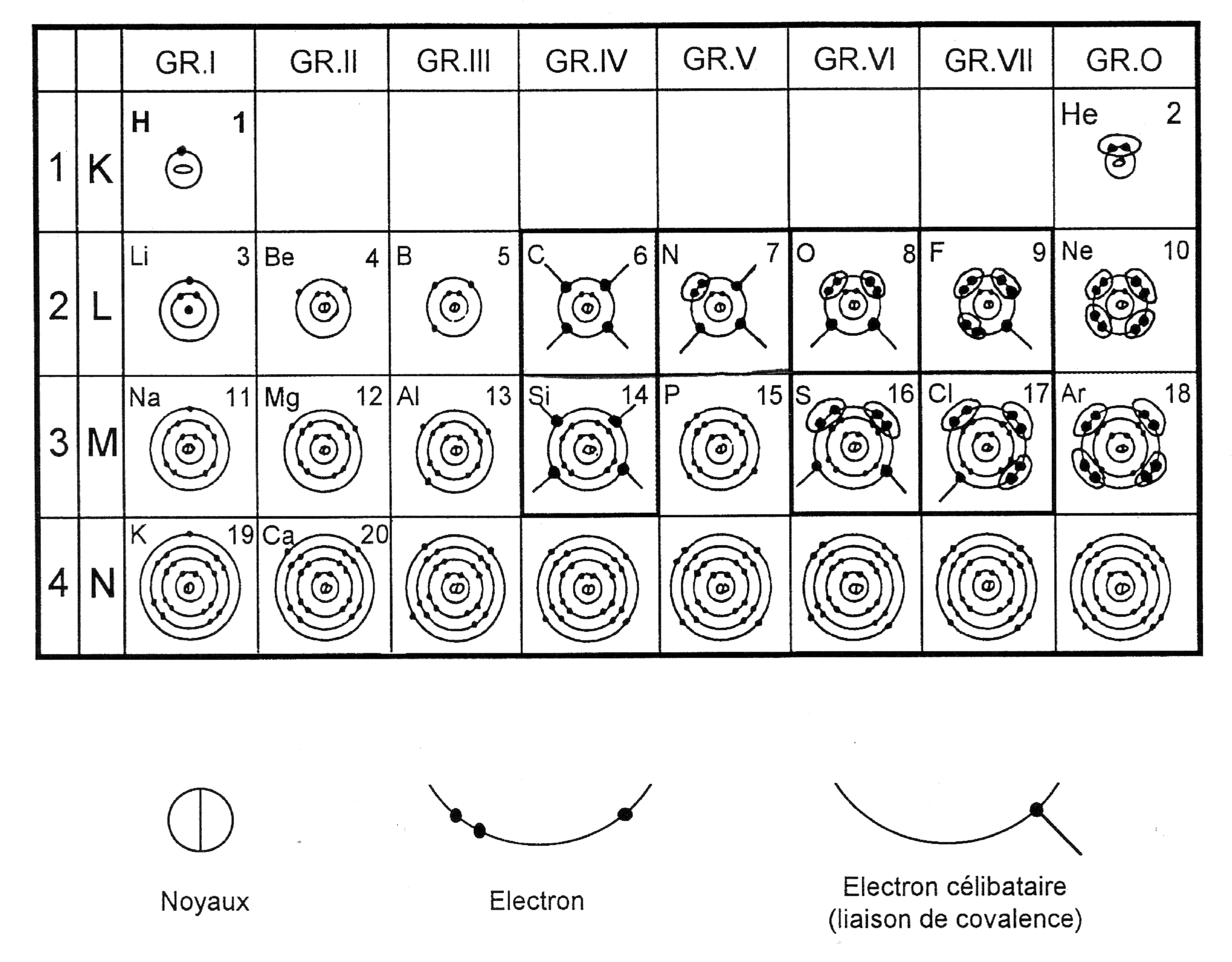
Un atome doit avoir un certain nombre d’électrons pour être équilibré (saturé). C’est le cas des éléments du groupe O (Hélion He, Néon Ne, Argon Ar…)
Sur tous les autres atomes représentés sur le tableau ci-dessus, il manque des électrons pour qu’ils soient équilibrés. C’est la cas du Carbone C, Azote N, Oxygène O…
Les électrons représentés seuls sont dits « électrons célibataires ». Pour que l’atome soit équilibré, il lui manque un certain nombre d’électrons (il veut ressembler à l’atome saturé de la même ligne, groupe O). Il va donc s’unir à un ou plusieurs atomes qui ont eux aussi des électrons célibataires pour former une molécule et obtenir un équilibre.
Exemple :
Représentation des nuages électroniques
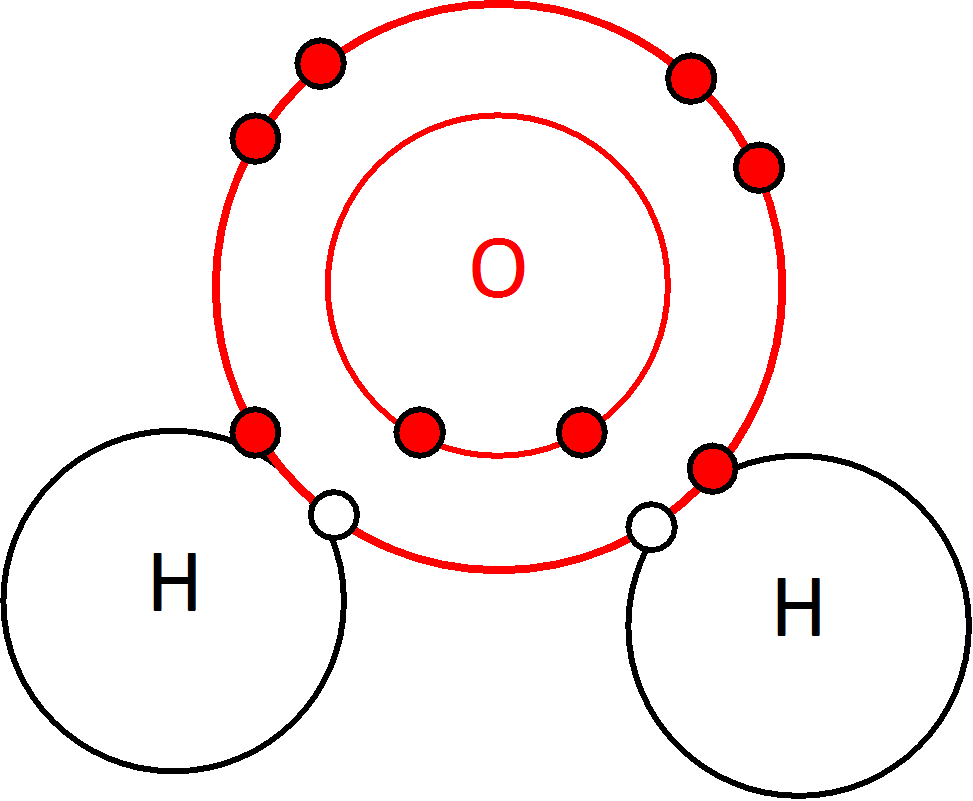
O Oxygène : 2 électrons libres sur sa dernière couche
H Hydrogène : 1 électron libre sur sa dernière couche
____________________________________
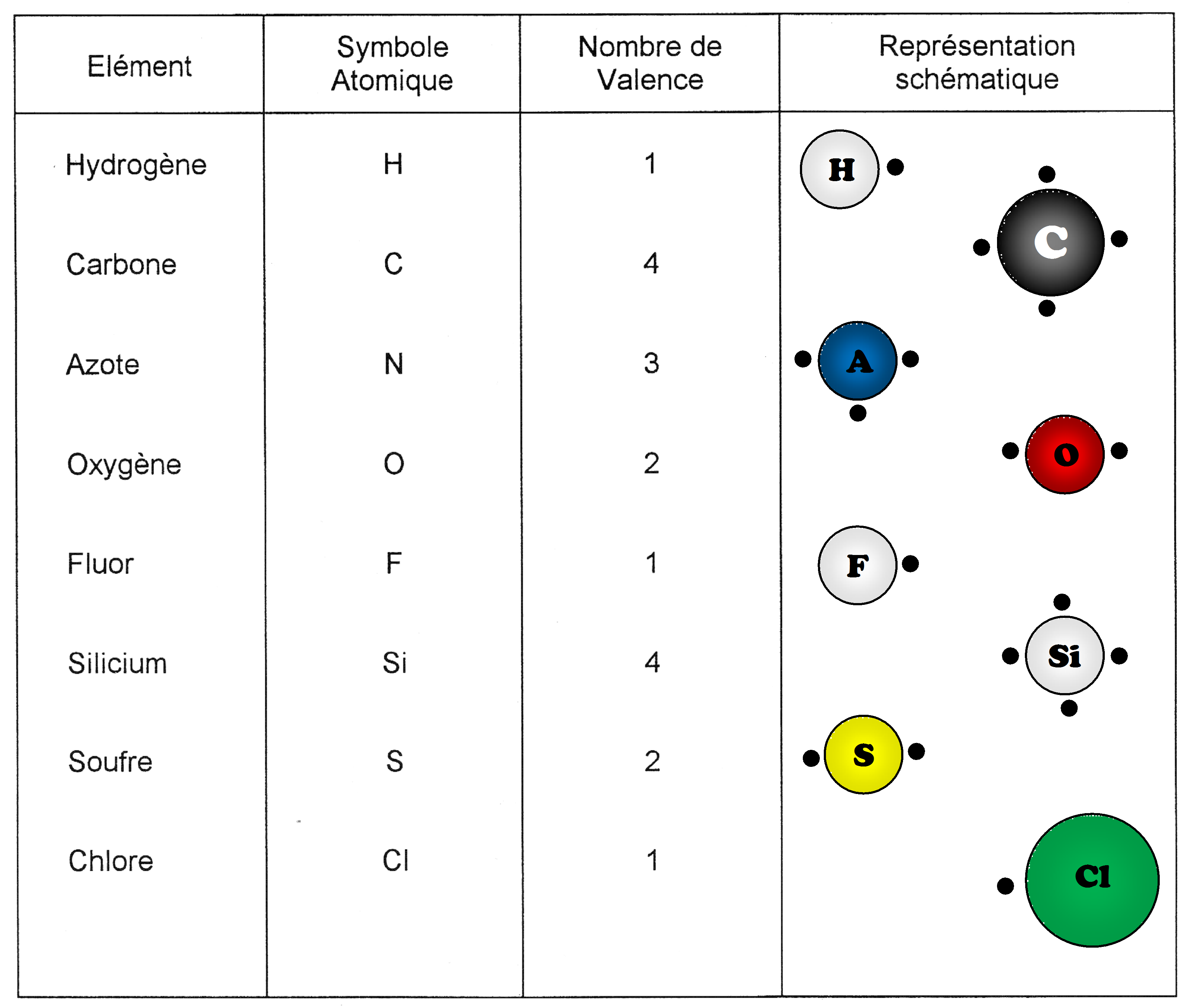
La figure ci-dessous représente les atomes utilisés pour la fabrication des matières plastiques, leur symbole, le nombre de valence libre (électrons célibataires) ainsi que leur représentation schématique.
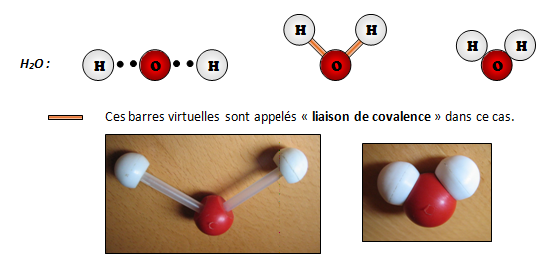
Reprenons l’exemple de l’eau, en prenant en considération les électrons célibataires. Un atome non équilibré (avec des électrons célibataires) ne peut pas rester seul dans la nature, il va devoir trouver un atome qui lui convient afin d’être équilibré. Ci-dessous, on peut voir le fonctionnement et la liaison entre les 3 atomes.
Créé avec HelpNDoc Personal Edition: Générateur de documentation et EPub facile